Drssa Afrodita Alexe
Cos’è il collagene?
Il collagene è una macroproteina di origine solo animale (non esiste un collagene vegetale) e finora ne sono stati evidenziati circa 42 tipi diversi; i più indagati dalla scienza – oltre all’interesse morfo-fisiologico umano - sono i collageni di origine bovina, marina e da pollame.
I tessuti connettivi svolgono funzioni essenziali per il corpo:
- protezione e resistenza agli impatti,
- supporto strutturale e metabolico per gli altri tessuti,
- sostegno meccanico,
- trasporto dei nutrienti e ossigeno verso i distretti ed organi,
- riserva energetica
- difese immunitarie
In linea di massima, il tessuto connettivo è formato da
- fibre di elastina, fibre reticolari, fibre di collagene
- matrice extracellulare (o sostanza fondamentale): può essere liquida (il sangue, la linfa), gelatinosa (cartilagini), solida (osso); rappresenta un miscuglio di acqua, proteine complesse (capacità legante), polisaccaridi (capacità di fluidizzare ed elasticizzare)
- cellule (fibroblasti, adipociti, leucociti, macrofagi, mastociti)
La sintesi del collagene
Il collagene viene sintetizzato nei fibroblasti, una famiglia particolare di cellule del tessuto connettivo, con funzione di sintesi e rinnovo dei componenti del tessuto connettivo stesso (componenti della matrice, collageni, elastina, fibronectina, enzimi, fattori di crescita, eparine, acido ialuronico…)
Ad oggi sono stati identificati 42 tipi di collageni: per 28 di questi, metabolismo e funzioni sono state decifrate con chiarezza, mentre gli altri sono ancora oggetti di ricerca (come le proteine di membrana tipo‐collagene quali ad esempio la ectodisplasina, il “macrophage receptor with collagenous structure” – MARCO - e sostanze del tipo recettori “scavenger” dei macrofagi, che solo recentemente sono stati riclassificati e considerati collageni).
I principali tipi di collagene
I collageni vengono denotati in cifre romane e classificati in sottocategorie:
- fibrillari
- associati alla fibrille
- di ancoraggio e rete
- di transmembrana
- di difesa (immunitaria / infiammatoria)
la matrice con le sue relative caratteristiche è funzione di tipo e diversità, quantità, disposizione e interconnessione dei collageni al suo interno.
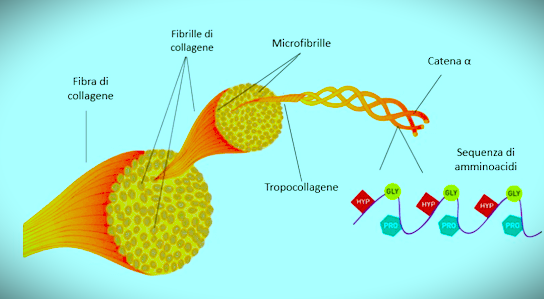
Le fibre di collagene sono robuste e resistenti alla trazione, flessibili ma non estensibili; ogni fibra ne è composta da decine di fibrille sottili, a loro volta fatte di microfibrille disposte a fasce parallele; il grado di rigidità / flessibilità ne dettano la funzione e la collocazione (come ad esempio, nell’osso sono presenti fibre di massima rigidità e resistenza).
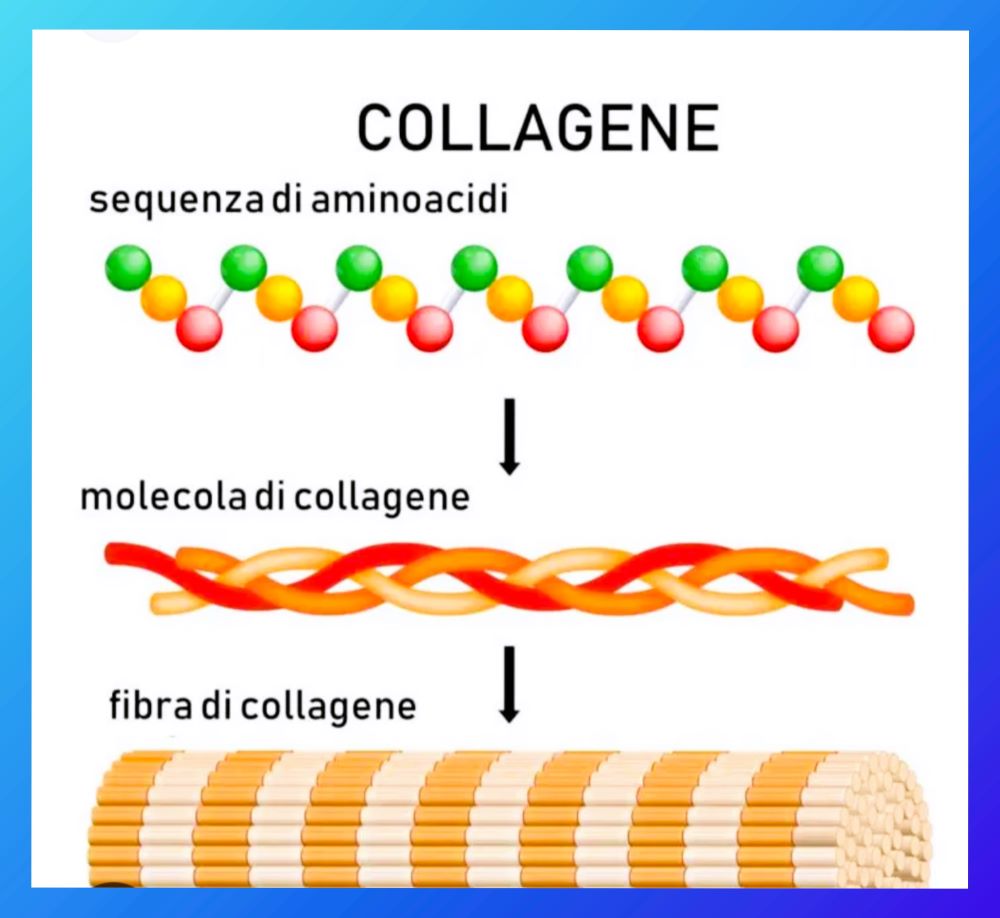
La struttura delle molecole di collageni
L’analisi per componenti della macromolecola di collagene immaturo ha identificato una sequenza primaria ripetitiva – un peptide - formata da 3 amminoacidi: glicina (il più piccolo amminoacido nel corpo umano), prolina ed idrossiprolina ; è presente in discrete quantità anche l’amminoacido idrossilisina.
Questa sequenza viene ripetuta per formare delle catene polipeptidiche (denominate alfa) le quali si avvolgono l’una sull’altra verso sinistra a forma di elica; le eliche a loro volta si avvolgono l’un l’altra e creano una sorta di cavo superavvolto destrorso; questa struttura base porta il nome di tropocollagene ed ha una massa di circa 245 kilodalton.
All’interno delle catene, la sequenza regolare della glicina-prolina-idrossiprolina viene interrotta dall’inserimento di altri amminoacidi (per caratterizzare la flessibilità delle catene e specificare le aggregazioni e le interazioni con gli altri componenti della matrice); al posto dell’idrossiprolina si può trovare qualsiasi altro amminoacido.
La sequenza amminoacidica è alquanto regolare: nelle singole catene polipeptidiche un residuo ogni tre è sempre la glicina, la quale costituisce circa il 30% del totale strutturale della macromolecola.
Tutti i tipi di collagene esistenti in natura contengono almeno 1 tripla elica; nei collageni più comuni, la tripla elica si assembla in microfibrille, che a loro volta si organizzano in fibrille e infine in fibre le quali si possono estendere fino a qualche millimetro di lunghezza.
La classificazione dei tipi di collagene viene fatta in base alla ripetizione della sequenza base nella macromolecola, al tipo di amminoacidi disposti ad interruzione all’interno dell’elica ed alla disposizione delle catene nella macromolecola.
Quanti tipi di collagene ci sono?
Nel corpo umano sono stati identificati 28 (i più studiati) fino a 42 (incluse molecole aggiunte recentemente dalla ricerca scientifica) tipi di collageni diversi; la ricerca si è soffermata a lungo sul collagene del tipo I, tipo II, tipo IV, tipo V, tipo VI, tipo IX per rappresentazione e diffusione nei tessuti e correlata funzione strutturale e di supporto organico.
Collagene tipo I (1) - fibrillare
- è il collagene più abbondante nel nostro corpo, rappresentando circa il 90% del totale;
- si trova nella pelle (derma), ossa e denti (dentina), tendini, cartilagini, tessuto adiposo, cornea
Collagene tipo II – fibrillare; forma le cartilagini (la ialina è il tipo di cartilagine più diffuso nel corpo umano), i dischi intervertebrali, l’umor vitreo
Collagene tipo III – fibrillare; costituisce il tessuto di granulazione e l’endostruttura dei vasi sanguigni
Collagene tipo IV – rete-formatore; costituisce la parte principale della lamina basale (membrana basale: membrana da interfaccia tra tessuto connettivo e tessuto epiteliale); ad esempio
- a livello della pelle la lamina basale fa da interfaccia tra l’epidermide e il derma; fa anche da filtro per il passaggio delle molecole di grandi dimensioni
- a livello del glomerulo renale, la lamina basale è ricca di collagene tipo IV che si organizza in un reticolo flessibile responsabile della capacità tensile della lamina stessa
Collagene tipo V – fibrillare; si trova nella giunzione dermo-epidermica; nella placenta; nei capelli; su tutte le superfici cellulari
Collagene tipo VI – formante fibre da ancoraggio che aiutano a collegare la lamina basale degli epiteli pluristratificati al sottostante tessuto connettivo; si trova nei tessuti interstiziali, associato al tipo I
Collagene tipo IX – associato alla fibrille, si trova nelle cartilagini, nel corpo vitreo, nella cornea; associato al collagene tipo II
Collageni transmembrana – tipo XIII ( interagisce con recettori tipo integrine e componenti della lamina basale); tipo XVII (denominato anche BP-AG2 o BP180, si trova negli emidesmosomi (strutture proteiche con ruolo di punto di giunzione tra le cellule dell’epitelio e la lamina basale)
Anche se presenti in minore quantità, i collageni transmembranari e quelli intracitoplasmatici hanno ruoli di vitale importanza per l’interconnessione cellulare, conduzione recettoriale, attivazione della trasduzione cellulare, nei meccanismi di difesa ecc.
Le funzioni del collagene
Il collagene è la proteina strutturale più importante del nostro corpo:
- forma fibre a cavo che danno forza e resistenza ai tendini
- forma lamine elastiche di varie dimensioni che danno sostegno strutturale alla pelle e supporto agli organi interni
- forma materia dura (inglobando minerali) come componente dei denti e ossa
- rappresenta il componente principale di protezione, sostegno e connessione dei tessuti molli con altri tessuti
All’interno della matrice extracellulare, le fibre di collagene sono rivestite dalle proteine presenti (glicosamminoglicani e proteoglicani) e in questa maniera acquisiscono proprietà di bio-sensori e bio-conduttori ovvero capacità di conduzione degli impulsi nervosi generati, con una velocità che può arrivare a più di 60m/s.
La vitamina C (acido ascorbico) e il collagene
All’interno delle fibre di collagene, l’amminoacido idrossiprolina viene aggiunto dopo che si formano le eliche, modificando la prolina già inserita: la reazione di conversione utilizza l’acido ascorbico (vitamina C) come agente ossidoriduttivo.
La mancanza di vitamina C interrompe la formazione di nuovo collagene, con conseguenze infauste sulla buona funzionalità dell’intero organismo; una delle malattie più comuni dei secoli scorsi era lo scorbuto, patologia che si manifesta con sintomi come la perdita dei denti e la desquamazione della pelle e che è dovuto alla mancata sintesi di nuovo collagene (necessario per la riparazione tissutale primaria) per via del deficit di vitamina C.
Il collagene nella pelle
La composizione e la quantità di collagene nella pelle subisce trasformazioni con l’avanzare dell’età: già dai 20 anni in poi, la produzione di nuovo collagene rallenta e il nostro corpo non è più in grado di sostituire il collagene degradato con la stessa velocità con la quale esso si rompe; le fibre diventano più sottili, più friabili, più deboli; queste modifiche si traducono per segni visibili dell’invecchiamento cutaneo:
- pelle sottile e secca, cadente, meno elastica
- pelle spenta opaca e rugosa
- comparsa di linee sottili, rughe e rughette
La perdita strutturale di collagene nella pelle matura è strettamente collegata alle modifiche qualitative e quantitative dell’acido ialuronico: molecola fondamentale per l’idratazione della pelle, l’acido ialuronico provvede a legare l’acqua al collagene; gioca ruolo fondamentale nell’attivazione della sintesi macroproteica nei fibroblasti agendo sulla differenziazione degli stessi in fibrociti i quali producono collagene, citochine, fattori di crescita angiogenica e fibrogenica ecc.
Ad oggi sul mercato vi esistono moltissime proposte di formule a base di collagene intero o frammentato in associazione con acido ialuronico, vitamine e minerali, estratti botanici: sia per uso topico (in cosmesi ed estetica) sia come integratori alimentari e nutrizionali indirizzati per fasce di interesse (cosmesi ed estetica ma anche come cure complementari delle patologie infiammatorie croniche cutanee, articolari, muscolo-scheletriche, d’organo ecc.

La farmacia Pelizzo tradizionale farmacia di turno a Udine in quanto aperta da lunedì a domenica sempre con orario continuato, mantiene disponibili per gli utenti durante tutta l’estate senza interruzioni i reparti Cosmesi&Estetica ed Integrazione&Nutrizione, all’interno dei quali si possono trovare le soluzioni mirate per le più svariate esigenze e fabbisogni individuali: per maggiori info e per il counselling personalizzato non esitate a contattarci.
articoli correlati
Acido ialuronico: cos’è e come si usa nei prodotti cosmetici
https://www.farmaciapelizzo.it/news/l%E2%80%99acido-ialuronico-cos%E2%80...
Acido ialuronico negli integratori alimentari e nutrizionali
https://www.farmaciapelizzo.it/news/l%E2%80%99acido-ialuronico-negli-int...
fonti essenziali
researchgate.net (Dr.E.Papakonstantinou et all)
Lodish et al., 7° ed
S. Ricard-Blum, The Collagen Family, in Cold Spring Harbor Perspectives in Biology, vol. 3, n. 1, 2011, pp. a004978, DOI:10.1101/cshperspect.a004978, PMC 3003457, PMID 21421911.




